ΑΠΟΛΥΤΗΡΙΕΣ ΕΞΕΤΑΣΕΙΣ Δ΄ ΤΑΞΗΣ
ΕΣΠΕΡΙΝΟΥ ΓΕΝΙΚΟΥ ΛΥΚΕΙΟΥ
ΠΕΜΠΤΗ 21 ΜΑΪΟΥ 2009
ΕΞΕΤΑΖΟΜΕΝΟ ΜΑΘΗΜΑ ΘΕΤΙΚΗΣ
ΚΑΤΕΥΘΥΝΣΗΣ: ΧΗΜΕΙΑ
ΘΕΜΑ 1ο
Για τις προτάσεις 1.1 έως και 1.3 να γράψετε στο τετράδιό σας τον αριθμό της πρότασης και δίπλα το γράμμα που αντιστοιχεί στο σωστό συμπλήρωμά της.
1.1. Από τις παρακάτω τετράδες κβαντικών αριθμών (n, ℓ, mℓ, ms) δεν είναι δυνατή η
Μονάδες 5
1.2. Το πιθανό pH διαλύματος ασθενούς οξέος ΗΑ 10-3Μ στους 25oC είναι
α. 11
β. 3
γ. 5
δ. 0
Μονάδες 5
1.3. Στο μόριο του CH2=CH-CH-Br υπάρχουν
α. 9σ δεσμοί.
β. 5σ και 4π δεσμοί.
γ. 7σ και 2π δεσμοί.
δ. 8σ και 1π δεσμοί.
Moνάδες 5
1.4. Να χαρακτηρίσετε τις προτάσεις που ακολουθούν, γράφοντας στο τετράδιό σας τη λέξη «Σωστό» ή «Λάθος» δίπλα στο γράμμα που αντιστοιχεί σε κάθε πρόταση.
α. Σε μια περίοδο του περιοδικού πίνακα η ενέργεια πρώτου ιοντισμού (Εi1) μειώνεται με την αύξηση του ατομικού αριθμού δηλαδή από αριστερά προς τα δεξιά.
β. Με την αύξηση της θερμοκρασίας η τιμή της σταθεράς ιοντισμού του νερού Kw αυξάνεται.
γ. Οι αλκοόλες (ROH) αντιδρούν με Na.
Moνάδες 6
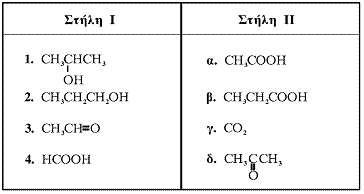
1.5. Να αντιστοιχίσετε σε κάθε μία από τις οργανικές ενώσεις (Στήλη Ι) το σωστό προϊόν της πλήρους οξείδωσής της (Στήλη ΙΙ) γράφοντας στο τετράδιό σας τον αριθμό της Στήλης Ι και δίπλα το αντίστοιχο γράμμα της Στήλης ΙΙ.
(όλες οι οξειδώσεις γίνονται με υδατικό διάλυμα KMnO4 παρουσία H2SO4).
Μονάδες 4
ΘΕΜΑ 2ο
2.1. Δίνονται τα στοιχεία 8Ο, 35Br και 7Ν.
α. Να γράψετε την ηλεκτρονιακή δομή των ατόμων τους (κατανομή ηλεκτρονίων σε υποστιβάδες) στη θεμελιώδη κατάσταση.
Moνάδες 3
β. Να δικαιολογήσετε ποιο από τα άτομα Ο, Ν έχει τη μεγαλύτερη ατομική ακτίνα.
Moνάδες 3
γ. Να γράψετε τον ηλεκτρονιακό τύπο κατά Lewis της ένωσης ΗBrO.
Δίνεται ο ατομικός αριθμός Η:1
Moνάδες 3
2.2. Διαθέτουμε υδατικό διάλυμα ΝΗ4Cl.
α. Το διάλυμα αυτό είναι όξινο, βασικό ή ουδέτερο;
Μονάδες 1
Δικαιολογήστε την απάντησή σας.
Μονάδες 4
β. Στο διάλυμα αυτό προσθέτουμε στερεό NaCl, χωρίς μεταβολή του όγκου του διαλύματος και της θερμοκρασίας. Το pH του διαλύματος θα αυξηθεί, θα μειωθεί ή θα παραμείνει σταθερό;
Μονάδες 1
Δικαιολογήστε την απάντησή σας.
Μονάδες 4
2.3. Να μεταφέρετε στο τετράδιό σας σωστά συμπληρωμένες τις παρακάτω χημικές εξισώσεις:
Μονάδες 6
ΘΕΜΑ 3ο
Δίνεται το παρακάτω διάγραμμα χημικών μετατροπών.
α. Να γράψετε τους συντακτικούς τύπους των οργανικών ενώσεων Α,Β,Γ και Δ.
Μονάδες 16
β.1. Να γράψετε σωστά συμπληρωμένη τη χημική εξίσωση της οξείδωσης της ένωσης CH3CH=O με υδατικό διάλυμα K2Cr2O7 παρουσία Η2SΟ4.
Μονάδες 4
β.2. Nα υπολογίσετε τον όγκο του διαλύματος K2Cr2O7 0,1Μ που απαιτείται για την οξείδωση 0,6mol CH3CH=O.
Μονάδες 5
ΘΕΜΑ 4ο
Διαθέτουμε 4L υδατικού διαλύματος ΝΗ3 0,1Μ (Διάλυμα Δ1).
α. Να υπολογίσετε το pH του διαλύματος Δ1.
Μονάδες 10
β. Στο διάλυμα Δ1 προσθέτουμε 0,2 mol αερίου HCl χωρίς να μεταβληθεί ο όγκος του διαλύματος. Να βρεθεί το pH του διαλύματος που θα προκύψει.
Μονάδες 15
Δίνεται ότι όλα τα διαλύματα βρίσκονται σε θερμοκρασία θ=25οC, KbNH3=10-5, Kw=10-14.
Τα δεδομένα του προβλήματος επιτρέπουν τις γνωστές προσεγγίσεις.




Δεν υπάρχουν σχόλια:
Δημοσίευση σχολίου